钟荣强 1,2 李金环2 白文轩3 张丽3 余江3
1. 中石化西北油田分公司石油工程技术研究院 2. 中石化石油工程设计有限公司
3. 北京化工大学化工学院能源环境催化北京市重点实验室
摘要:目的为了解决铁基离子液体(BmimFeCl4/Fe(Ⅲ)-IL)湿法氧化脱除硫化氢(H2S)技术再生效率低的问题,本研究利用Cu(Ⅱ)对铁基离子液体脱硫富液的再生性能进行强化。方法 为避免铁基离子液体脱硫富液中未反应的溶解态硫化氢分子对再生过程的干扰,制备了模拟铁基离子液体脱硫富液(Fe(Ⅱ/Ⅲ)-IL),并通过FT-IR、Raman和CV等表征,验证模拟体系的可靠性。随后,将Cu(Ⅱ)引入至铁基离子液体脱硫富液中,并添加了聚乙二醇二甲醚(NHD)降低脱硫富液的黏度,构建了Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL/NHD复合体系。结果 当复合体系中Cu(Ⅱ)质量浓度为4.36 mg/L时,在120 min内可实现脱硫富液的全部再生。结论通过考查溶剂配比、亚铁离子质量浓度、铜离子质量浓度、水质量分数、温度、氧气流量等因素对脱硫富液再生性能的影响,优化了金属基离子液脱硫体系,使其为适应石油与天然气等化石能源的开采和工业应用过程的可持续发展需求提供了新的选择。
关键词:铁基离子液体;硫化氢;脱硫富液再生;铜基离子液体;氧化脱硫
DOI: 10.3936/j.issn.1007-3426.2025.01.001
引用格式:钟荣强, 李金环, 白文轩, 等. Cu(Ⅱ)强化铁基离子液体脱硫富液氧化再生性能研究[J]. 石油与天然气化工, 2025, 54(1): xx-xx.
ZHONG R Q, LI J H, BAI W X, et al. Study on the regenerative performance of Cu(II) enhanced iron-based ionic liquid desulfurization rich liquid[J]. Chemical Engineering of Oil & Gas, 2025, 54(1): xx-xx.
Study on the regenerative performance of Cu(II) enhanced iron-based ionic liquid desulfurization rich liquid
ZHONG Rongqiang1,2, LI Jinhuan2, BAI Wenxuan3, ZHANG Li3, Yu Jiang3
1. Petroleum Engineering Technology Research Institute of Sinopec Northwest Oilfield Branch, Sinopec, Urumqi, Xinjiang, China; 2. Sinopec Petroleum Engineering Corporation, Dongying, Shandong, China
3. Beijing Key Laboratory of Energy Environmental Catalysis, College of Chemical Engineering, Beijing University of Chemical Technology, Beijing, China
Abstract: Objective In order to solve the problem of low regeneration efficiency in the wet oxidation removal of hydrogen sulfide (H2S) using iron-based ionic liquid (BmimFeCl4/Fe(III)-IL), this study utilized Cu(II) to enhance the regeneration performance of iron-based ionic liquid desulfurization rich solution. Methods In order to avoid the interference of unreacted dissolved hydrogen sulfide molecules in the iron-based ionic liquid desulfurization rich liquid on the regeneration process, a simulated iron-based ionic liquid desulfurization rich liquid (Fe(Ⅱ/III)-IL) was prepared, and the reliability of the simulated system was verified by ch aracterization such as FT-IR, Raman and CV. Subsequently, Cu(II) was introduced into the iron-based ionic liquid desulfurization rich liquid, and poly(ethylene glycol) dimethyl ether (NHD) was added to reduce the viscosity of the desulfurization rich liquid, and the composite system of Cu(II)@Fe(II/III)-IL/NHD was constructed. Results When the mass concentration of Cu(II) in the composite system was 4.36 mg/L, the desulfurization rich solution can be completely regenerated within 120 min. Conclusion By investigating the effects of solvent ratio, Fe(II) and Cu(II) concentrations, water content, temperature, and oxygen flow rate on the regeneration performance of the desulfurization rich liquid, the metal-based ionic liquid desulfurization system was optimized, which could provide a new choice for adapting to the sustainable development needs of fossil energy exploitation and industrial application processes such as oil and natural gas.
Keywords: iron-based ionic liquid; hydrogen sulfide; desulfurization rich liquid regeneration; copper-based ionic liquid; oxidative desulfurization
2 结果与讨论
2.1 模拟脱硫富液的表征
2.1.1 模拟脱硫富液的红外光谱
据Bai等的报道,铁基离子液体(BmimFeCl4)对H2S的转化能力较弱[15],而余江等的研究也表明在铁基离子液体脱硫的过程中,部分H2S仅以溶解态形式存在于铁基离子液体中,而未被转化为硫磺[23]。因此,为了避免溶解态H2S对铁基离子液体脱硫富液再生性能的影响,分别合成Fe(Ⅲ)-IL和Fe(Ⅱ)-IL,再按一定配比模拟Fe(Ⅱ/Ⅲ)-IL脱硫富液,以考查铜基离子液体(Cu(Ⅱ)-IL)对脱硫富液再生性能的影响。为了确保模拟脱硫富液的可靠性,本研究先对模拟脱硫富液与真实脱硫富液进行表征,分析两者的异同点。
在Fe(Ⅱ)质量浓度为1.5 mg/L、扫描频数为32次、分辨率为4 cm-1的条件下,模拟脱硫富液与真实脱硫富液的红外光谱图,见图2。由图2可知,模拟脱硫富液与真实条件下的脱硫富液的红外光谱基本一致,这说明模拟脱硫富液与真实脱硫富液的官能团结构是一样的。在3148 cm-1和3086 cm-1处的特征峰,分别归属于咪唑环上C4,5—H和C2—H的伸缩振动峰[24];2935 cm-1观测到了较强的烷基链C—H伸缩振动峰;1382 cm-1处的特征峰归属于甲基上C—H的弯曲振动;1165 cm-1处出现了咪唑环的伸缩振动峰;此外,在3600 cm-1左右,出现了水分子的羟基振动峰,表明无论是模拟脱硫富液还是真实脱硫富液均具备较强的吸水性能[25]。
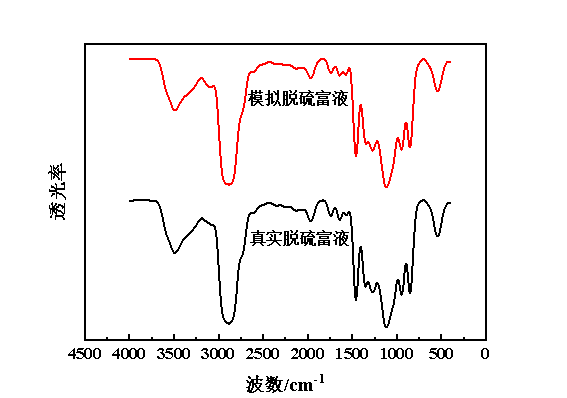
图2 模拟脱硫富液与真实脱硫富液的红外光谱图
2.1.2 模拟脱硫富液的拉曼光谱
本研究应用Renishaw 1024 CCD-1040×256检测器,在Fe(Ⅱ)质量浓度为1.5 mg/L的条件下,考察了模拟脱硫富液与真实脱硫富液的拉曼光谱图,见图3。根据相关报道,[Fe(Ⅲ)Cl4]-的拉曼光谱特征峰出现在120 cm-1和333 cm-1处,385 cm-1处的特征峰可能是Fe(Ⅲ)和Fe(Ⅱ)共同作用的特征峰[26-27]。此外,图3中并未在370 cm-1处发现[Fe(Ⅲ)2Cl7]-的特征峰。值得一提的是,模拟脱硫富液与真实脱硫富液的拉曼谱图并无显著差异,结合红外光谱可知,所制备的模拟脱硫富液的空间构型与真实脱硫富液基本保持一致。
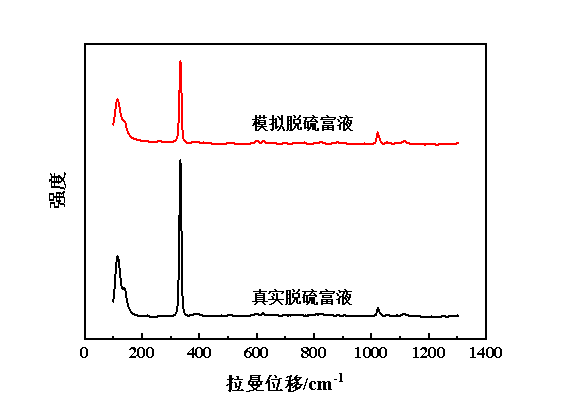
图3 模拟脱硫富液与真实脱硫富液的拉曼光谱图
2.1.3 模拟脱硫富液的循环伏安特性曲线
为了探究模拟脱硫富液与真实脱硫富液氧化还原性能差异,在Fe(Ⅱ)质量浓度为1.5 mg/L、扫描速率为50 mV/s、温度为298.2 K、工作电极为玻碳、辅助电极为Ag/AgCl、参比电极为铂丝的条件下,进行了循环伏安特性曲线的表征,结果见图4。由图4可知,无论是模拟脱硫富液还是真实脱硫富液,两者的循环伏安特性曲线均具备优越的对称性,表明其具备较好的氧化还原可逆性。
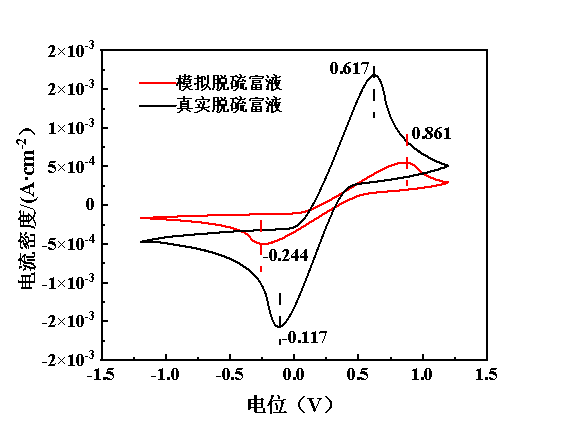
图4 模拟脱硫富液与真实脱硫富液的循环伏安特性曲线
然而,模拟脱硫富液的电流密度却显著低于真实脱硫富液,且模拟脱硫富液的氧化峰电位高于真实脱硫富液,而还原峰电位却低于真实脱硫富液,前者的两峰电位差为0.861 V,显著高于后者(0.734 V)。根据Sitze等的报道,铁基离子液体的电流密度主要受到离子迁移和离子含量的影响[27]。本研究中均将模拟脱硫富液和真实脱硫富液中的亚铁离子含量控制为相同,因此,电流密度主要受到脱硫剂中离子迁移速率的影响。真实脱硫富液与模拟体系的主要区别在于,真实脱硫富液中会存在H2S电离生成的H+,由此可知,真实脱硫富液中的H+能够促进铁基离子液体中的离子迁移过程,导致电流密度高于模拟体系[28]。
此外,模拟脱硫富液中的氧化峰与还原峰的电位差较高,表明其中铁离子的氧化还原活性弱于真实脱硫富液。Bai和Liu等的研究表明铁基离子液体中的氢键网络直接影响到了铁基离子的氧化还原活性,氢离子的存在,能够通过与[Fe(Ⅲ)Cl4]-形成H—Cl氢键的形式,提高铁离子活性[15,19,29],因此,真实脱硫富液的氧化峰与还原峰的电位差低于模拟体系。但正因为模拟体系的氧化还原性能更弱,Cu(Ⅱ)-IL对再生性能强化的影响反而更加显著。
综上,本研究合成的模拟脱硫富液与真实体系结构基本一致,性能相似,可满足再生过程的研究需求。
2.2 模拟脱硫富液的再生性能
2.2.1 NHD配比对模拟脱硫富液再生性能的影响
由于铁基离子液体自身的黏度较高,常通过引入有机溶剂的形式降低其黏度,以提升其气液传质性能。张丽等的研究表明NHD能够有效地强化铁基离子液体的脱硫性能[13]。因此,本研究首先构建Fe(Ⅱ/Ⅲ)-IL/NHD复合体系,在Fe(Ⅱ)质量浓度为12 mg/L、氧气流量为50 mL/min、温度为298.2 K的条件下,考查不同Fe(Ⅱ/Ⅲ)-IL和NHD配比对再生性能的影响,结果见图5。
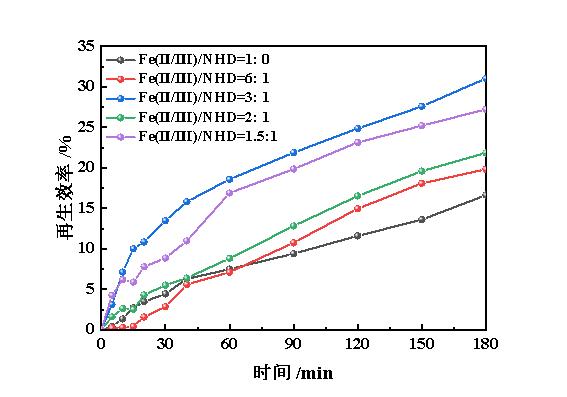
图5 Fe(Ⅱ/Ⅲ)-IL与NHD体积比对Fe(Ⅱ/Ⅲ)-IL/NHD脱硫富液再生性能的影响
由图5可知,引入NHD的脱硫富液的再生效率明显高于单独的Fe(Ⅱ/Ⅲ)-IL。随着NHD比例的进一步增加,脱硫富液的再生性能呈现出先增强后降低的趋势,当Fe(Ⅱ/Ⅲ)-IL与NHD体积比为3∶1时,表现出最佳的再生性能。这是因为:①NHD能够显著降低脱硫富液的黏度(图6),从而提升了气液传质效果,使再生性能随之增加;②聚醚醇类溶剂可能会通过溶剂化效应降低铁离子活性[15],故再生性能又随之降低。
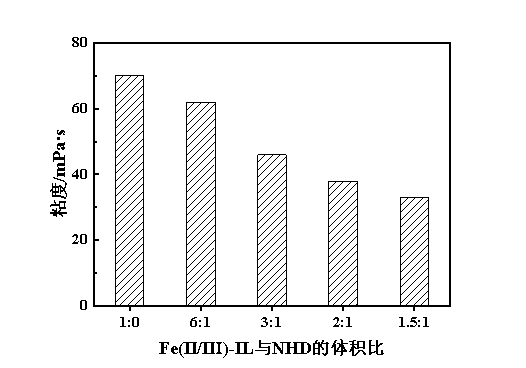
图6 Fe(Ⅱ/Ⅲ)-IL与NHD体积比对Fe(Ⅱ/Ⅲ)-IL/NHD脱硫富液黏度的影响
2.2.2 Fe(Ⅱ)含量对模拟脱硫富液再生性能的影响
以Fe(Ⅱ/Ⅲ)-IL与NHD体积比3∶1为基础体系,在氧气流量为50 mL/min、温度为298.2 K的条件下,考查了亚铁离子质量浓度对脱硫富液再生性能的影响,如图7所示。由图7可知,随着亚铁离子质量浓度的升高,脱硫富液的再生性能显著提升,这表明亚铁离子的质量浓度与再生速率相关,也就意味着高浓度的亚铁离子容易实现转化,而低浓度的亚铁离子转化则更加困难,由于再生过程中的氧气流量保持一致,因此低质量浓度亚铁离子的氧气利用率必定显著低于高质量浓度的亚铁离子,由此可见,实现亚铁离子的全部转化,难以通过工艺过程进行实现,需对脱硫剂的配伍进行调整。
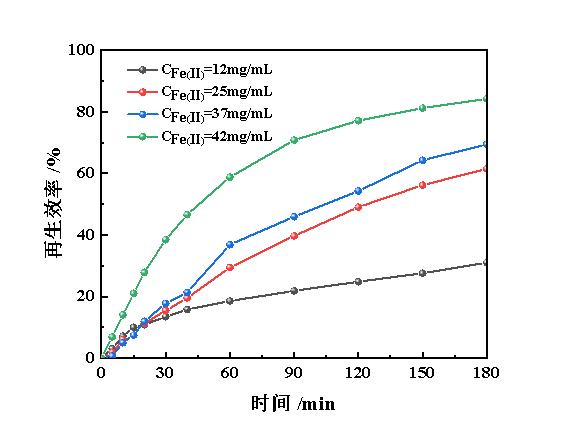
图7 亚铁离子质量浓度对Fe(Ⅱ/Ⅲ)-IL/NHD再生性能的影响
2.2.3 Cu(Ⅱ)含量对模拟脱硫富液再生性能的影响
胡锦超等的研究认为,多金属基离子液体相较于纯的铁基离子液体对H2S的催化氧化过程具备显著的强化作用[20],白文轩等也提出关于二元金属基离子液体协同氧化脱硫机制[3]。因此本研究向Fe(Ⅱ/Ⅲ)-IL/NHD中引入了Cu(Ⅱ)-IL,在Fe(Ⅱ/Ⅲ)-IL和NHD体积比为3∶1、Fe(Ⅱ)质量浓度为25 mg/L、氧气流量为50 mL/min、温度为298.2 K的条件下,考查其对再生性能的影响,结果见图8。
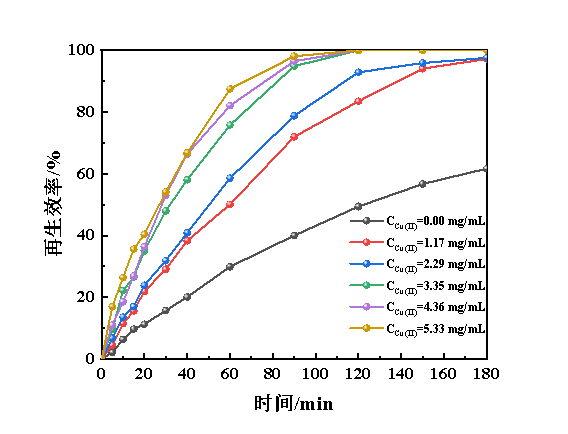
图8 铜离子浓度对Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL/NHD再生性能的影响
由图8可知,引入了Cu-IL的脱硫富液再生性能显著优于Fe(Ⅱ/Ⅲ)-IL/NHD,且随着Cu(Ⅱ)含量的进一步提高,其再生效率也明显提升,当Cu(Ⅱ)质量浓度高于3.35 mg/mL时,120 min可实现脱硫富液的全部再生。此外,当Cu(Ⅱ)质量浓度超过4.36 mg/mL时,继续增加Cu(Ⅱ)含量,脱硫富液的再生效率基本保持不变。由此可知,Cu(Ⅱ)对脱硫富液的再生性能具备极其显著的强化效果,Cu(Ⅱ)的强化作用一方面是由于Cu(Ⅱ)可能提升亚铁离子的反应活性,另一方面,Cu(Ⅱ)和Cu(Ⅰ)作为氧化还原介体可实现对反应过程的催化效果[30-31]。
2.2.4 氧气流量对模拟脱硫富液再生性能的影响
在Fe(Ⅱ/Ⅲ)-IL和NHD体积比为3:1、Fe(Ⅱ)质量浓度为25 mg/L、Cu(Ⅱ)质量浓度为4.36 mg/L、温度为298.2 K的条件下,考查氧气流量对Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL/NHD再生性能的影响,见图9。由图9可知,当氧气流量由50 mL/min提升至100 mL/min时,脱硫富液的再生性能显著提升,30 min的再生效率由54.3%提升至88.4%;但当氧气流量由100 mL/min提升至150 mL/min时,亚铁离子的氧化速率基本保持不变,这表明在该氧气流量下,气液传质基本无法影响再生性能,此时影响再生过程的关键因素在于氧气和亚铁离子间的氧化还原反应。
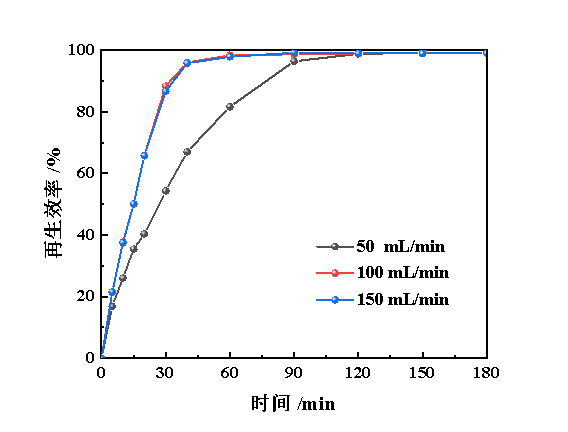
图9 氧气流量对Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL/NHD再生性能的影响
2.2.5 水含量对模拟脱硫富液再生性能的影响
由2.1.1节可知,无论是模拟脱硫富液还是真实脱硫富液均具备一定的吸水性,且脱硫富液再生过程中也会产生水分子,因此,在Fe(Ⅱ/Ⅲ)-IL和NHD体积比为3∶1、Fe(Ⅱ)质量浓度为25 mg/L、Cu(Ⅱ)质量浓度为4.36 mg/L、温度为298.2 K、氧气流量为50 mL/min的条件下,考查了水含量对Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL/NHD脱硫富液再生性能的影响,结果见图10。
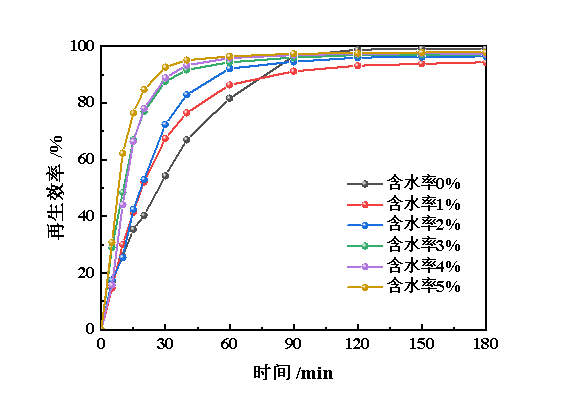
图10 水含量对Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL/NHD再生性能的影响
由图10可知,随着水质量分数的增加,模拟脱硫富液的再生性能随之显著提升。在40 min时,未引入水的脱硫富液再生效率为67.1%,而水质量分数为5%的脱硫富液再生效率则高达95.1%。但引入水后,90 min后脱硫富液的再生效率要低于无水体系。因此,水分子对脱硫富液再生性能的影响是个多因素过程。首先,水的黏度远小于脱硫富液黏度,故引入水后,脱硫富液黏度降低,从而提高了亚铁离子的反应速率,但水分子也可能会与金属离子发生配位或者水解反应,导致亚铁离子的反应活性受到影响,因此,不利于低质量浓度亚铁离子的转化。但综合来看,水分子对脱硫富液的再生性能的提升作用更加显著。
2.2.6 温度对模拟脱硫富液再生性能的影响
在Fe(Ⅱ/Ⅲ)-IL和NHD体积比为3∶1、Fe(Ⅱ)质量浓度为25 mg/L、Cu(Ⅱ)质量浓度为4.36 mg/L、温度为298.2 K、氧气流量为50 mL/min的条件下,考查了温度对Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL/NHD脱硫富液再生性能的影响,见图11。由图11可知,当温度为298.2~313.2 K时,脱硫富液的再生性能基本不受温度的影响;但随着温度进一步升高至333.2 K时,脱硫富液的再生性能开始降低,120 min时的再生效率由97.6%降至93.4%。通常,温度升高会显著降低气体在液体中的溶解度,由此可以推测,温度升高降低了氧气分子在脱硫富液中的溶解度[32],从而降低了再生效率。
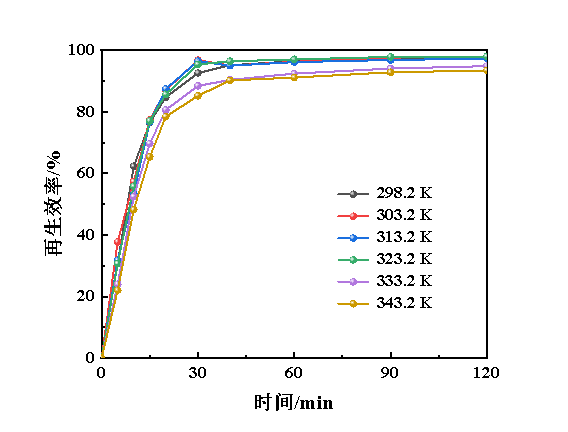
图11 温度对Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL/NHD再生性能的影响
2.3 铜基离子液体强化脱硫富液的再生机制
为深入探究铜基离子液体对铁基离子液体脱硫富液的强化机制,在Fe(Ⅱ)质量浓度为25 mg/L、Cu(Ⅱ)质量浓度为4.36 mg/L、扫描速率为50 mV/s、温度为298.2 K、工作电极为玻碳、辅助电极为Ag/AgCl、参比电极为铂丝的条件下,对引入Cu(Ⅱ)-IL前后的Fe(Ⅱ/Ⅲ)-IL进行了循环伏安特性曲线表征,结果见图12。由图12可知,当Cu(Ⅱ)-IL引入到Fe(Ⅱ/Ⅲ)-IL后,其氧化峰电位由0.956 V降低至0.936 V,还原峰电位由-0.320 V提升至-0.294 V,两峰电位差由1.276 V降至1.230 V。两峰电位差值的降低表明引入Cu(Ⅱ)-IL可提升脱硫富液的氧化还原性能,因此,引入Cu(Ⅱ)-IL后的脱硫富液再生性能显著提升。氧化还原性能提升的可能原因为:①铜基离子液体自身的氧化峰和还原峰电位差较小,降低了复合体系的氧化还原峰电位差;②铁基离子液体和铜基离子液体之间存在协同活化作用,增加了整体的氧化还原性能。
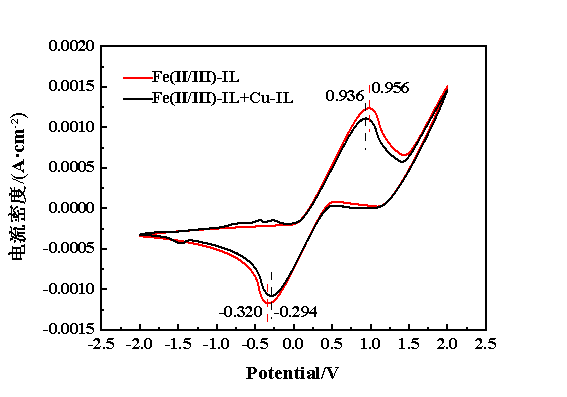
图12 Fe(Ⅱ/Ⅲ)-IL与Cu(Ⅱ)@Fe(Ⅱ/Ⅲ)-IL的循环伏安特性曲线
根据图12的结果,推测了两种Cu(Ⅱ)-IL强化铁基离子脱硫富液的强化机制,见图13。图13(a)展示了Cu(Ⅱ)可能与Fe(Ⅱ)通过与氯离子竞争配位的方式,弱化了原有的Fe(Ⅱ)-Cl配位作用,从而提高了Fe(Ⅱ)的反应活性,这种活化机制主要依托于Fe(Ⅱ)-IL和Cu(Ⅱ)-IL的协同作用[3]。而图13(b)则展示了一种以Cu(Ⅱ)/Cu(Ⅰ)作为氧化还原介体的反应机制,Cu(Ⅱ)可能会与Fe(Ⅱ)先发生反应,生成Cu(Ⅰ)与Fe(Ⅲ),而Cu(Ⅰ)又易被氧气氧化为Cu(Ⅱ),由此对脱硫富液的再生起到了催化作用,此类强化机制的实现得益于铜基离子液体可能具备更低的氧化还原峰电位差,这一特性使其能够作为有效的氧化还原介体,加速亚铁离子的氧化反应。
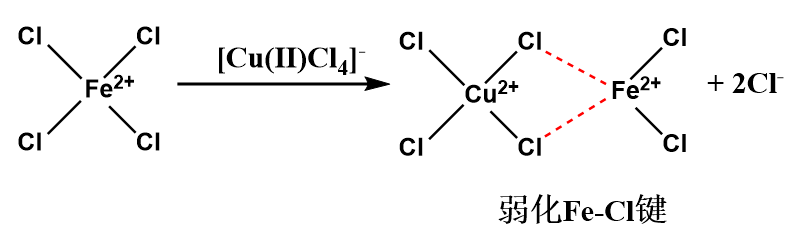
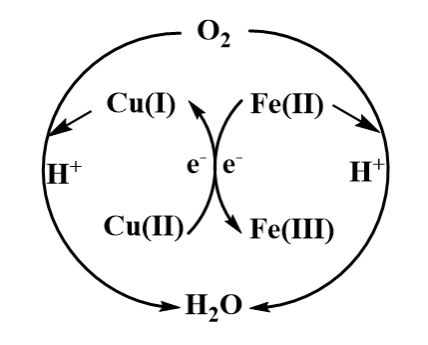
(a) 竞争配位; (b) 氧化还原介体
图13 铜基离子液体强化脱硫富液再生机制
3 结论
1)红外光谱、拉曼光谱与循环伏安特性曲线的结果表明,所制备的模拟铁基离子液体脱硫富液与真实条件下的铁基离子液体脱硫富液结构基本一致,可用于研究脱硫富液再生性能。
2)铜基离子液体的引入可大幅度提升铁基离子液体脱硫富液的再生性能,铜离子的最佳质量浓度为4.36 mg/mL。适当地引入水分子能够进一步提高脱硫富液的再生性能,在298.2~323.2 K的温度区间内,120 min时,脱硫富液的再生性能可维持在97%以上。
3)循环伏安特性曲线的结果表明,铜基离子液体的引入可降低氧化峰和还原峰的电位差,从而提升其再生反应活性。
参考文献
[15]BAI W X, CHEN J X, LIU F, et al. Effects of aprotic solvents on the physicochemical properties and ferric ion oxidation activity of iron-based ionic liquids[J]. Physical Chemistry Chemical Physics, 2023, 25(8): 6295-6305.
[16]王建宏, 朱玲.[bmim]FeCl4离子液体催化氧化硫化氢的研究[J]. 天然气化工-C1化学与化工, 2012, 37(6): 29-32.
[17]WANG J H, ZHANG W D. Oxidative absorption of hydrogen sulfide by iron-containing ionic liquids[J]. Energy & Fuels, 2014, 28(9): 5930-5935.
[18]LIU F, YU J, QAZI A B, et al. Metal-based ionic liquids in cxidative desulfurization: a critical review[J]. Environmental Science & Technology, 2021, 55(3): 1419-1435.
[19]LIU F, BAI W X, GU Z P, et al. Determination of the acidic structure and Lewis activity in an Fe-based ionic liquid with slope analysis of the quantitative pyridine-IR spectrum[J]. New Journal of Chemistry, 2023, 47(10): 4761-4774.
[20]胡锦超, 高丽霞, 刘伟海, 等. 复合离子液体组成对硫化氢的氧化脱硫性能的影响[J]. 化工学报, 2016, 67(S1): 347-352.
[21]张俊丰, 童志权. Fe/Cu体系湿式催化氧化一步高效脱除H2S新方法研究[J]. 环境科学学报, 2005, 25(4): 497-501.
[22]郭智慧, 张婷婷, 顾佳佳, 等. 铁基离子液的水相合成工艺[J]. 化工学报, 2013, 64(增刊1): 198-202.
[23]余江, 钱明超, 李佳璠, 等. 一种硫化氢净化及硫磺分离工艺: CN108689386B[P]. 2020-12-11.
[24]ZHANG Y Q, ZHANG T, HUO F, et al. Structure and interaction properties of MBIL[Bmim][FeCl4] and methanol: a combined FTIR and simulation study[J]. Journal of Molecular Liquids, 2020, 309: 113061.
[25]ZHAO D, SULTANA A, EDBERG J, et al. The role of absorbed water in ionic liquid cellulosic electrolytes for ionic thermoelectrics[J]. Journal of Materials Chemistry C, 2022, 10: 2732-2741.
[26]GUO Z H, ZHANG T T, KHAN M, et al. Electrochemical behavior of iron-based imidazolium chloride ionic liquids[J]. Electrochimica Acta, 2014, 142: 132-143.
[27]SITZE M S, SCHREITER E R, PATTERSON E V, et al. Ionic liquids based on FeCl3 and FeCl2. Raman scattering and ab initio calculations[J]. Inorganic Chemistry, 2001, 40(10): 2298-2304.
[28]LIU F, ZHANG J C, BAI W X, et al. Development of phase-change absorbent for hydrogen chloride with hydrogen and chlorine generation by electrolysis[J]. Chemical Engineering Journal, 2023, 463: 142482.
[29]DONG K, ZHANG S J, WANG D X, et al. Hydrogen bonds in imidazolium ionic liquids[J]. The Journal of Physical Chemistry A, 2006, 110(31): 9775-9782.
[30]WANG G L, LIU Y C, ZHANG X Y, et al. Mechanistic investigation into single-electron oxidative addition of single-Atom Cu(I)-N4 site: revealing the Cu(I)–Cu(II)–Cu(I) catalytic cycle in photochemical hydrophosphinylation[J]. Journal of the American Chemical Society, 2024, 146(12): 8668-8676.
[31]DING Y C, LI D Y, ZUO S Y, et al. Boron-doping accelerated Cu(II)/Cu(I) cycle for enhancing peroxymonosulfate activation[J]. Separation and Purification Technology, 2022, 282: 120086.
[32]SATO T, HAMADA Y, SUMIKAWA M, et al. Solubility of oxygen in organic solvents and calculation of the hansen solubility parameters of oxygen[J]. Industrial & Engineering Chemistry Research, 2014, 53(49): 19331-19337.
收稿日期:2024-07-11;编辑:温冬云
